

Il tumore della prostata rappresenta la seconda neoplasia più frequente al mondo nel sesso maschile. In Italia, esso rappresenta il primo tumore per incidenza tra i maschi, con una sopravvivenza a 5 anni dalla diagnosi pari al 92% (valore in costante e sensibile crescita grazie soprattutto all’anticipazione diagnostica e alla correlata diminuzione di casi di malattia in stadio avanzato al momento della diagnosi). Per quanto riguarda la mortalità, in costante e moderata diminuzione, tale neoplasia si presenta al terzo posto tra le cause di morte per patologia tumorale.
Nello scenario clinico di questa malattia, esiste una percentuale di pazienti che a seguito del trattamento di prima scelta, rappresentato dall’intervento chirurgico di prostatectomia radicale o radioterapia, va incontro a progressione e diffusione metastatica. Questo, in aggiunta alla percentuale di casi di malattia in stadio avanzato alla diagnosi, ha reso necessario inquadrare e rivalutare sotto il profilo diagnostico e terapeutico un quadro clinico particolare rappresentato dal paziente oligometastatico. Per tale ragione, nel corso degli anni si è assistito ad una ridefinizione dello stato di malattia e di conseguenza dell’iter terapeutico, al fine di garantire il miglior trattamento possibile, a seconda dei possibili diversi scenari clinici.
Tra i primi a focalizzarsi sull’importanza di questa distinzione, furono Hellman e Weichselbaum (1) che nel 1995 avanzarono l’ipotesi di considerare lo stato oligometastatico come un sottogruppo di pazienti con numero limitato di metastasi, tale da poter considerare la malattia “potenzialmente curabile”. A partire da qui, molti sono gli studi che hanno cercato di definire in maniera sempre più specifica lo stato di malattia oligometastatica: nello specifico, a partire dal 2015 sono stati pubblicati oltre 600 articoli incentrati su questo argomento. Tra questi, il 20% riguarda i tumori della prostata. Nel 2015, la Advanced Prostate Cancer Consensus Conference di San Gallo (APCC) (2) ha dichiarato che “la definizione più appropriata di tumore della prostata oligometastatico è la presenza di 3 o meno metastasi sincrone (coinvolgenti osso e/o linfonodi)”. Tuttavia nel 2017, la stessa APCC (3) ha ridefinito il concetto di oligometastasi ponendo l’attenzione su elementi sempre più specifici, quali il numero e la sede delle lesioni, la presenza di malattia sensibile o resistente alla castrazione, la comparsa di metastasi sincrone o metacrone e le modalità di imaging utilizzate per l’identificazione delle metastasi. Su questo nuovo scenario, si sono affermati i dati forniti dagli studi LATITUDE e CHAARTED, con l’elaborazione di criteri ancor più precisi e utili, al fine di garantire un miglior inquadramento di questa patologia. Nel primo studio citato (4), la presenza di due o più dei seguenti criteri definisce un tumore “ad alto rischio”: presenza di tre o più metastasi ossee, metastasi viscerali e grado istologico secondo la classificazione ISUP ≥4. Nello studio CHAARTED (5), invece, i criteri considerati sono rappresentati da: presenza di quattro o più metastasi ossee di cui almeno una esterna allo scheletro assile, o metastasi viscerali.
Alla luce di queste nuove definizioni, la tendenza sempre più diffusa è quella di considerare lo scenario clinico oligometastatico, come uno stadio intermedio di malattia avanzata, tra malattia metastastica localizzata e malattia metastatica diffusa portando alla necessità di identificare procedure diagnostiche e terapeutiche appropriate e selezionate. Per quanto riguarda le indagini strumentali, nonostante l’affermazione di metodiche sempre più accurate quali risonanza magnetica whole-body, 68Ga-PSMA-PET-TC, 18F-PSMA-PET-TC, 18-F-flucilcovina-PET-TC non esiste ancora uno standard diagnostico preciso per l’identificazione delle diverse possibili manifestazioni cliniche di questa patologia.
La stessa problematica dell’inquadramento diagnostico, si riscontra anche nello stabilire il miglior iter terapeutico nei pazienti con malattia oligometastatica. L’idea di una terapia multimodale, basata sulla combinazione di diverse strategie terapeutiche è sempre più sostenuta, rimandando la decisione ad una discussione collegiale che coinvolga rispettivamente urologi, oncologi e radioterapisti. La scelta del miglior iter terapeutico viene effettuata all’interno di un’ampia selezione di trattamenti combinati, includendo terapie sistemiche e trattamenti locali. Per quanto riguarda la terapia sistemica, nel corso degli anni sono stati pubblicati numerosi studi che hanno dimostrato l’efficacia dell’aggiunta della chemioterapia sia nei pazienti con malattia ormono-sensibile, che in quelli resistenti alla castrazione; l’obiettivo terapeutico è quello di garantire un miglior controllo di malattia, la riduzione dei sintomi e complicanze ad essa correlate, e prolungamento della sopravvivenza. Tra gli studi più rilevanti in questo ambito si annoverano: CHAARTED, STAMPEDE e GETUG-AFU15 (6) che hanno valutato l’effetto dell’aggiunta della chemioterapia (nello specifico, docetaxel) alla terapia ormonale.
Lo studio CHAARTED (7) è stato il primo ad aver documentato un vantaggio in termini di OS (Overall Survival) pari a 13,6 mesi a favore della terapia combinata: ADT (Androgen Deprivation Therapy) + docetaxel (VI cicli totali) rispetto alla sola ADT [HR (hazard ratio) 0,61; 95% CI, 0,45-0,81; p<0,001] soprattutto in caso di malattia avanzata (presenza di metastasi viscerali, 4 o più metastasi ossee di cui almeno una esterna allo scheletro assile).
A seguire nel 2019, lo studio STAMPEDE (8) ha confermato l’efficacia della terapia combinata (ADT + docetaxel e/o acido zoledronico) rispetto alla sola terapia ormonale, con beneficio in termini di OS incrementato di 10 mesi [HR 0,78; 95% CI (Confidence Interval), 0,66-0,93; p=0,006] senza particolari differenze tra le varie sottocategorie analizzate (compresi i casi di malattia localmente avanzata ad elevato rischio di micrometastasi, che quelli con coinvolgimento linfonodale).
Lo studio GETUG 15 (fase III) è stato invece il primo ad analizzare il ruolo della chemioterapia nel tumore della prostata ormono-sensibile metastatico; i risultati ottenuti hanno mostrato: un incremento in termini di OS mediana a 7 anni pari a 13,5 mesi (HR 0,88; 95% CI, 0,68-1,14; p=3), una diminuzione del rischio di morte per malattia del 22% e una migliore PFS radiografica (HR 0,69; 95% CI, 0,55-0,87; p=0,002).
In aggiunta a questi, studi controllati randomizzati (Tabella 1) hanno mostrato l’efficacia della terapia combinata con i nuovi antagonisti dei recettori androgenici (enzalutamide, abiraterone ed apalutamide) in pazienti con malattia metastatica ampliando il numero di strategie terapeutiche a disposizione per questa categoria di pazienti. Sulla base dei risultati ottenuti dai più recenti studi clinici, non esiste ancora una scelta terapeutica combinata di prima linea; allo stato attuale, sono infatti necessarie ulteriori analisi comparative che possano mettere in luce le prerogative a favore di una scelta terapeutica piuttosto che un’altra; come nella metanalisi (9) pubblicata nel 2018 da Feyeabend e Saad, che ha evidenziato un vantaggio nell’utilizzo dell’abiraterone rispetto al docetaxel in termini di QOL (Quality of Life) e PFS radiografica.
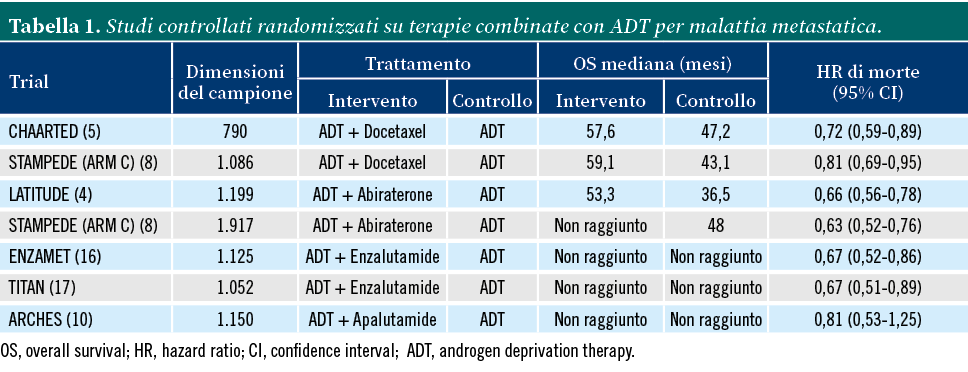
Le diverse possibili combinazioni con ADT consentono, ad oggi, di impostare un diverso programma terapeutico sulla base del caso specifico, tenendo conto delle condizioni generali del paziente, delle comorbidità di ciascuno e dei possibili effetti avversi legati ad ogni farmaco. In linea generale, lo schema terapeutico con docetaxel prevede un numero di cicli da 6 a 10, con somministrazione ogni 21 giorni e gli effetti collaterali più frequenti sono rappresentati da astenia, mielosoppressione e neurotossicità. Abiraterone (con prednisone), enzalutamide e apalutamide prevedono invece uno schema di somministrazione giornaliero fino a progressione di malattia o necessità di cambiare la terapia antineoplastica con un tempo di trattamento mediano pari a 33 mesi per abiraterone e 30 mesi per enzalutamide (5,10,11).
In merito agli eventi avversi, abiraterone con aggiunta di prednisone ha determinato casi di ipertensione, ipokaliemia, disturbi cardiovascolari e rialzo degli enzimi epatici; l’enzalutamide può causare invece disturbi vascolari (es. ischemia miocardica) e fratture. Il basso profilo tossicologico dell’apalutamide è stato ampiamente analizzato nello studio TITAN (12), evidenziando solo casi limitati di eruzioni cutanee, fratture e ipotiroidismo, tali per cui nella pratica clinica, viene ampiamente utilizzato in presenza di multiple comorbidità. Per quanto riguarda invece il ruolo delle terapie locali, è necessario porre l’attenzione sul duplice intervento che può essere fornito per il trattamento delle oligometastasi e del tumore primitivo; è stato, infatti, dimostrato come il trattamento chirurgico o radioterapico del tumore primitivo riesca ad influenzare lo sviluppo di “nicchie pre-metastatiche” e determini, inoltre, una riduzione dell’angiogenesi nelle lesioni a distanza, suggerendo l’ipotesi di un effetto abscopal (a distanza dal target) delle terapie locali.
Le finalità della radioterapia nel tumore della prostata sono da tempo ben consolidate; dal trattamento curativo nella malattia localizzata e nelle recidive locali dopo intervento di prostatectomia a quello palliativo in caso di malattia metastatica sintomatica. Rimane, tuttavia, ancora da definire con maggior precisione, il ruolo nello scenario del paziente oligometastatico.
Tra gli studi retrospettivi che hanno messo in evidenza il possibile beneficio di un trattamento combinato (ADT + radioterapia sulla malattia primitiva prostatica) nel paziente con malattia metastatica, si ricorda il lavoro pubblicato da Rusthoven et al. (15), che ha messo a confronto pazienti trattati con radioterapia in aggiunta ad ADT, e pazienti trattati con sola ADT, ottenendo valori in termini di OS pari a 53 vs. 29 mesi rispettivamente.
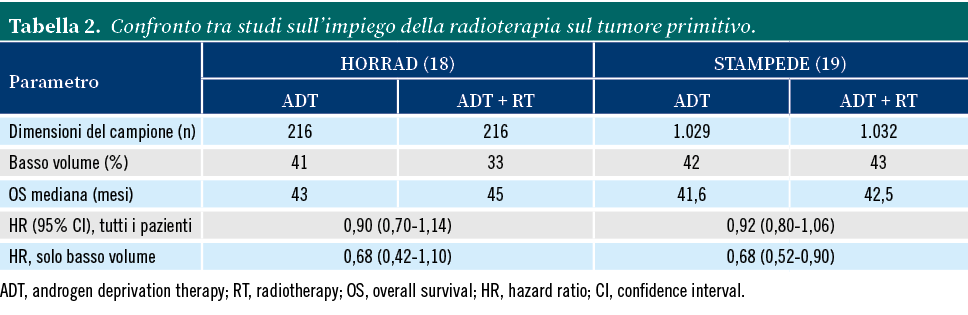
Negli studi HORRAD e STAMPEDE del 2019 (Tabella 2) è stato evidenziato un beneficio dato dall’aggiunta del trattamento radiante alla terapia ormonale, relativo solo a casi selezionati di pazienti con malattia metastatica limitata, nello specifico con meno di 4 metastasi ossee localizzate nello scheletro assile e nessuna metastasi viscerale, in accordo con i criteri CHAARTED (5).
Sono inoltre in corso diversi studi finalizzati a valutare i benefici del trattamento radiante o intervento di prostatectomia radicale rispetto alle varie terapie sistemiche (NCT01751438, PEACE-1 NCT03678025). In attesa dei risultati definitivi, la prospettiva è quella di avere nei prossimi anni un quadro sempre più chiaro in merito al ruolo delle terapie locali nel paziente con tumore della prostata oligometastatico.
Le Linee guida NCCN suggeriscono di considerare l’indicazione al trattamento radiante, oltre che nel caso di lesioni ossee sintomatiche e localizzazioni linfonodali di malattia, per trattamenti ipofrazionati in combinazione con ADT, al fine di migliorare il controllo locale e ridurre la durata del trattamento ormonale e dei suoi effetti avversi (14).
Tra gli schemi di ipofrazionamento proposti in letteratura in caso di malattia oligometastatica e non dichiaratamente con finalità palliativa, equivalenti in termini di efficacia, quelli più utilizzati sono stati: 16-20 Gy in frazione unica, 3 frazioni da 8-10 Gy, 5-7 frazioni da 7-5 Gy. Altro importante aspetto riguarda il trattamento locale delle metastasi a distanza; grazie anche allo studio di Goundem et al. pubblicato nel 2015 (13), in cui per la prima volta si è valutata la possibilità che non solo il tumore primario, ma anche le metastasi già presenti potessero essere uno stimolo per la formazione di nuove, si è compresa ulteriormente la necessità di intervenire, ove possibile, in modo selettivo ed efficace.
In questo ambito si inserisce il trattamento dei linfonodi patologici in caso di recidiva di malattia, ponendo l’attenzione sul possibile beneficio con un intervento di dissezione linfonodale di salvataggio o irradiazione, nei pazienti già sottoposti ad intervento di prostatectomia radicale in presenza di recidiva di malattia.
Lo studio randomizzato di fase II STOMP sta contribuendo nel valutare l’indicazione e il vantaggio fornito da trattamenti locali chirurgici o radioterapici su metastasi linfonodali od ossee (Metastases Directed Therapy, MDT) nel differire l'avvio della terapia ormonale nei pazienti con carcinoma della prostata oligoricorrente, lasciando intravedere un vantaggio in termini di sopravvivenza libera da terapia ormonale nei pazienti trattati ab initio con MDT rispetto ai pazienti posti in osservazione (20). Si attendono i risultati di questo ed ulteriori studi attualmente in corso, al fine di chiarire le migliori strategie da mettere in atto.
In aggiunta a questi, dati sempre più recenti forniti dall’analisi genomica hanno portato alla luce l’esistenza di differenze biologiche suggestive, tra casi di malattia oligometastatica e tumori ad ampia diffusione sistemica. Ulteriori ricerche sono attualmente in atto, al fine di identificare mediante biopsia liquida, biomarkers che possano mettere in evidenza la differente caratterizzazione molecolare tra malattia oligometastastica e malattia metastatica diffusa basandosi sull’analisi di cellule tumorali circolanti, DNA/RNA e micro-RNA al fine di consentire un miglior inquadramento clinico-patologico di questa neoplasia.